Empezando a investigar
Índice del CursoTema 7 - Aplicabilidad de los resultados del estudio
Para interpretar adecuadamente los resultados de un estudio, debemos hacernos las siguientes preguntas de manera secuencial: si la respuesta a alguna de ellas es «no», no merecerá la pena seguir adelante: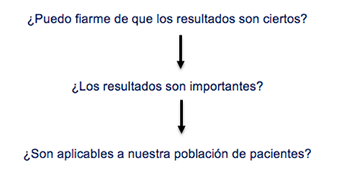
Pasemos a analizar con más detenimiento las tres cuestiones planteadas.
¿Puedo fiarme de que los resultados son ciertos?
Con esta pregunta estamos evaluando la validez interna del estudio. La validez interna nos determina si estamos valorando adecuadamente aquello que queremos evaluar. Por ejemplo: en un estudio experimental, indica hasta qué punto el investigador puede atribuir la variación observada en la variable dependiente a la presencia de la variable independiente.
Para realizar un estudio adecuado de la validez interna de un trabajo, debemos tener en cuenta las siguientes premisas:
- La valoración crítica de un estudio se basa en la información que está recogida en el manuscrito. Por tanto:
- Estudios bien hechos y mal escritos se valorarán mal.
- Estudios con sesgos pero bien escritos se pueden valorar positivamente.
- No existe estudio libre de errores: la clave es determinar si estos serán lo suficientemente grandes como para que la aportación del mismo sea irrelevante o equivocada. Debemos lograr un equilibrio entre la validez y la viabilidad: si esto no es posible, es mejor no iniciar la investigación.
Tipos de error
- Error aleatorio:
- Debido al azar.
- Relacionado con el tamaño muestral y la precisión.
- Error sistemático (sesgo): conduce a una estimación incorrecta del efecto.
Principales sesgos
- Sesgo de selección (selection bias).
- Sesgo de desgaste (attrition bias).
- Sesgo de realización (performance bias).
- Sesgo de detección (detection bias).
- Sesgo de selección:
- Inadecuada asignación aleatoria: los grupos no son comparables.
- Prevención:
- Generación de secuencias de asignación.
- Ocultación de las secuencias de asignación: ni los pacientes ni los investigadores deben conocer el grupo al que van a ser asignados.
- Ideal: sistema centralizado independiente (por ejemplo, telefónico).
- Sesgo de desgaste:
- Ocurrencia sesgada de pérdidas en el seguimiento y/o desviaciones del protocolo:
- Pacientes que no acuden a los exámenes.
- Pacientes que no inician el tratamiento.
- Pacientes con una adherencia inadecuada al tratamiento.
- Abandonos del estudio por decisión del investigador (por ejemplo, efectos adversos).
- Si las pérdidas son desiguales entre los grupos, estos dejan de ser comparables.
- Prevención:
- Análisis por intención de tratar: todos los pacientes asignados aleatoriamente a cada grupo se incluirán en el análisis en su grupo original, independientemente de si reciben el tratamiento.
- Limitaciones:
- A veces no se pueden medir los resultados finales en los pacientes perdidos ⇒ informar de las pérdidas y sus causas y valorar la posibilidad de sesgo de desgaste.
- Sesgo de realización:
- Provisión desigual de atención sanitaria adicional (aparte de los tratamientos que se evalúan)
- Contaminación: el grupo control recibe parte de la intervención del grupo experimental (ej. intervenciones educativas)
- Prevención: enmascaramiento de pacientes e investigadores que realizan las intervenciones (estudios doble ciego)
- Sesgo de detección:
- Valoración sesgada de los resultados:
- Los pacientes conocen el grupo de tratamiento al que pertenecen.
- Los profesionales que valoran los resultados conocen la asignación de los pacientes.
- Prevención: enmascaramiento de pacientes y profesionales que valoran los resultados.
En la siguiente tabla se recogen las principales diferencias entre la ocultación de la asignación y el enmascaramiento:
Ocultación de la asignación
| Enmascaramiento
|
En resumen, para prevenir los diferentes sesgos en nuestro estudio, debemos tener en cuenta lo siguiente:
- Sesgo de selección:
- Adecuación de la asignación aleatoria (con ocultación).
- Sesgo de desgaste:
- Describir la frecuencia de pérdidas en el seguimiento y causas.
- Describir la frecuencia de desviaciones de protocolo y causas.
- Realizar un análisis por intención de tratar.
- Sesgo de realización:
- Enmascaramiento de los profesionales que proporcionan la atención.
- Enmascaramiento de los pacientes.
- Sesgo de detección:
- Enmascaramiento de los profesionales que miden los resultados.
- Enmascaramiento de los pacientes.
Otros tipos de sesgos
- Sesgo de selección en estudios observacionales no analíticos: falta de representatividad de la muestra (por ejemplo, por baja tasa de respuesta en una encuesta).
- Sesgo de información (por ejemplo, errores sistemáticos por falta de adiestramiento de los investigadores, instrumentos de medida poco exactos o fiables, falsedad a la hora de responder el sujeto a un cuestionario, etc.).
- Sesgo de confusión: a controlar en el análisis estadístico.
¿Los resultados son importantes?
Magnitud de los resultados
Con el siguiente ejemplo vamos a describir las principales medidas de magnitud que debemos analizar.
Título del estudio: High-Dose Atorvastatin vs Usual-Dose Simvastatin for Secondary Prevention After Myocardial Infarction. The IDEAL Study: A Randomized Controlled Trial. JAMA 2005;294:2437-45.
En el estudio se incluyeron pacientes con infarto de miocardio previo. Una de las variables secundarias del estudio fue la ocurrencia de infarto agudo de miocardio no fatal (IAMNF) durante el período de estudio:
- Entre los 4.449 pacientes que recibieron 20 mg/día de simvastatina se observaron 321 IAMNF (7,2%).
- Entre los 4.439 pacientes que recibieron 80 mg/día de atorvastatina se observaron 267 IAMNF (6,0%).
- Reducción absoluta del riesgo (RAR): 7,2 – 6,0 = 1,2%.
- Reducción relativa del riesgo (RRR): (1,2 x 100) / 7,2 ≈ 17%.
- Razón de riesgos (hazard ratio: HR): 6,0 / 7,2 = 0,83 (IC 95% 0,71-0,98; p = 0,02). También se puede denominar riesgo relativo (RR).
- Número necesario de pacientes a tratar (NNT): 100 / RAR = 100 / 1,2 ≈ 83 ⇒ es necesario tratar a 83 pacientes con atorvastatina 80 mg/día durante 4,8 años (este fue el período de estudio) para prevenir un IAMNF.
Las conclusiones del estudio (patrocinado por una empresa farmacéutica que comercializa atorvastatina) fueron: «In this study of patients with previous MI, intensive lowering of LDL-C did not result in a significant reduction in the primary outcome of major coronary events, but did reduce the risk of other composite secondary end points and nonfatal acute MI. There were no differences in cardiovascular or all-cause mortality. Patients with MI may benefit from intensive lowering of LDL-C without an increase in noncardiovascular mortality or other serious adverse reactions».
Es decir, basándose en que existe una HR estadísticamente significativa, los autores concluyen que a los pacientes con IAM habría que tratarlos con dosis altas de estatinas (atorvastatina 80 mg/día durante casi 5 años) para prevenir un IAMNF por cada 83 pacientes tratados. Vosotros podéis sacar vuestras propias conclusiones…
Otros resultados a tener en cuenta
- Toxicidad:
- NND: número de individuos que habría que tratar para que se produjera un caso de efecto adverso (daño).
- Por ejemplo, el riesgo de hemorragia digestiva alta (HDA) anual con un fármaco es del 2%.
- NND: 100/2 ⇒ habría una HDA por cada 50 pacientes tratados durante 1 año.
- Adecuación: vía de administración, pauta, etc.
Detección de posibles «problemas»
Debemos tener en cuenta otros aspectos al interpretar los resultados de un estudio, como:
- Selección de la alternativa de comparación:
- No parece adecuado comparar un fármaco nuevo con placebo en casos en los que existe un tratamiento que ya ha probado su eficacia (por ejemplo, los nuevos antihipertensivos deberían demostrar su valor frente a otros antihipertensivos ya comercializados, en lugar de frente a placebo).
- No elección del mejor tratamiento alternativo disponible y/o no comparar dosis equipotentes (por ejemplo, dosis más altas con el tratamiento experimental que con el control).
- Tipo de resultados:
- Medición de resultados intermedios en lugar de finales. Por ejemplo, para demostrar la utilidad de un nuevo hipolipemiante, debería pedirse que redujese la morbimortalidad cardiovascular (resultado final), en lugar de conformarnos con que reduzca los niveles de colesterol (resultado intermedio).
- Tiempo de seguimiento
- Seguimientos cortos, con dificultad de detección de posibles acontecimientos adversos a más largo plazo ⇒ hay que tener precaución con las novedades terapéuticas cuando hay fármacos útiles en el tratamiento de esa patología (los fármacos nuevos se suelen aprobar con estudios con seguimientos cortos, por lo que no se puede descartar que aparezcan efectos adversos a medio/largo plazo).
¿Los resultados son aplicables a nuestra población de pacientes?
- Características de los pacientes incluidos (criterios de selección): edad, sexo, riesgo basal (gravedad/estadio de la enfermedad, comorbilidades...), etc.
- Tratamiento de estudio: dosis, duración, vía de administración, tratamientos concomitantes, etc.
- Ámbito: AP u hospitalaria, sistema sanitario, etc.
- Resultados: población incluida (población por intención de tratar, eficacia, seguridad), duración del seguimiento, etc.
Hay que tener en cuenta al menos las siguientes posibles limitaciones:
- Evaluar si las condiciones del estudio son similares/aplicables a nuestra práctica habitual:
- Profesionales involucrados en la intervención (por ejemplo, AP frente a atención hospitalaria).
- Equipamiento material y técnico similar al nuestro.
- Tiempo dedicado a la intervención y/o al seguimiento.
- Características de los pacientes incluidos: eficacia (condiciones «de laboratorio», con «pacientes escogidos») frente a efectividad (condiciones reales de la práctica clínica).
Podemos considerar dos actitudes diferenciadas a la hora de elegir el tipo de criterios de selección para nuestro estudio:
- Explicativa (eficacia): criterios muy estrictos ⇒ población homogénea, buena cumplidora:
- Ventaja: fácil encontrar un efecto/asociación, si existe.
- Problema: resultado poco generalizable.
- Pragmática (efectividad): criterios de selección amplios ⇒ población heterogénea:
- Ventaja: resultados generalizables.
- Problema: se pierde control sobre el estudio ⇒ mayor dificultad para hallar un efecto/asociación, si existe.
Por ejemplo, a la hora de analizar el efecto de un nuevo antihipertensivo (A) con uno conocido (B) podemos plantearnos dos tipos de enfoques:
- Explicativo: efecto del fármaco en condiciones ideales (eficacia). Solo analizaremos aquellos pacientes que hayan tomado el fármaco tal como se indica en el protocolo y de los que tengamos al menos una evaluación postratamiento (análisis por protocolo).
- Pragmático: efecto del fármaco en condiciones reales (práctica clínica habitual). Se analizarán todos los pacientes que cumplen los criterios de inclusión, incluyendo los incumplidores, los que deben abandonar por efectos secundarios, etc., como fracasos del tratamiento (análisis por intención de tratar).
Por último, os adjuntamos una herramienta muy práctica para la evaluación de un estudio en 11 pasos: CASPe (Critical Appraisal Skills Programme):
«Si os apasiona la ciencia, haceos científicos. No penséis lo que va a ser de vosotros. Si trabajáis firme y con entusiasmo, la ciencia llenará vuestra vida.»
SEVERO OCHOA


